大肠癌是一种“富贵病”。随着生活水平的提升和生活方式的变化,我国居民大肠癌的发病率不断提升。在上海,大肠癌已经位居常见恶性肿瘤第二位。发生转移是导致大肠癌患者死亡的重要原因。数据显示,近60%发生转移的肠癌转移目标都是肝脏。
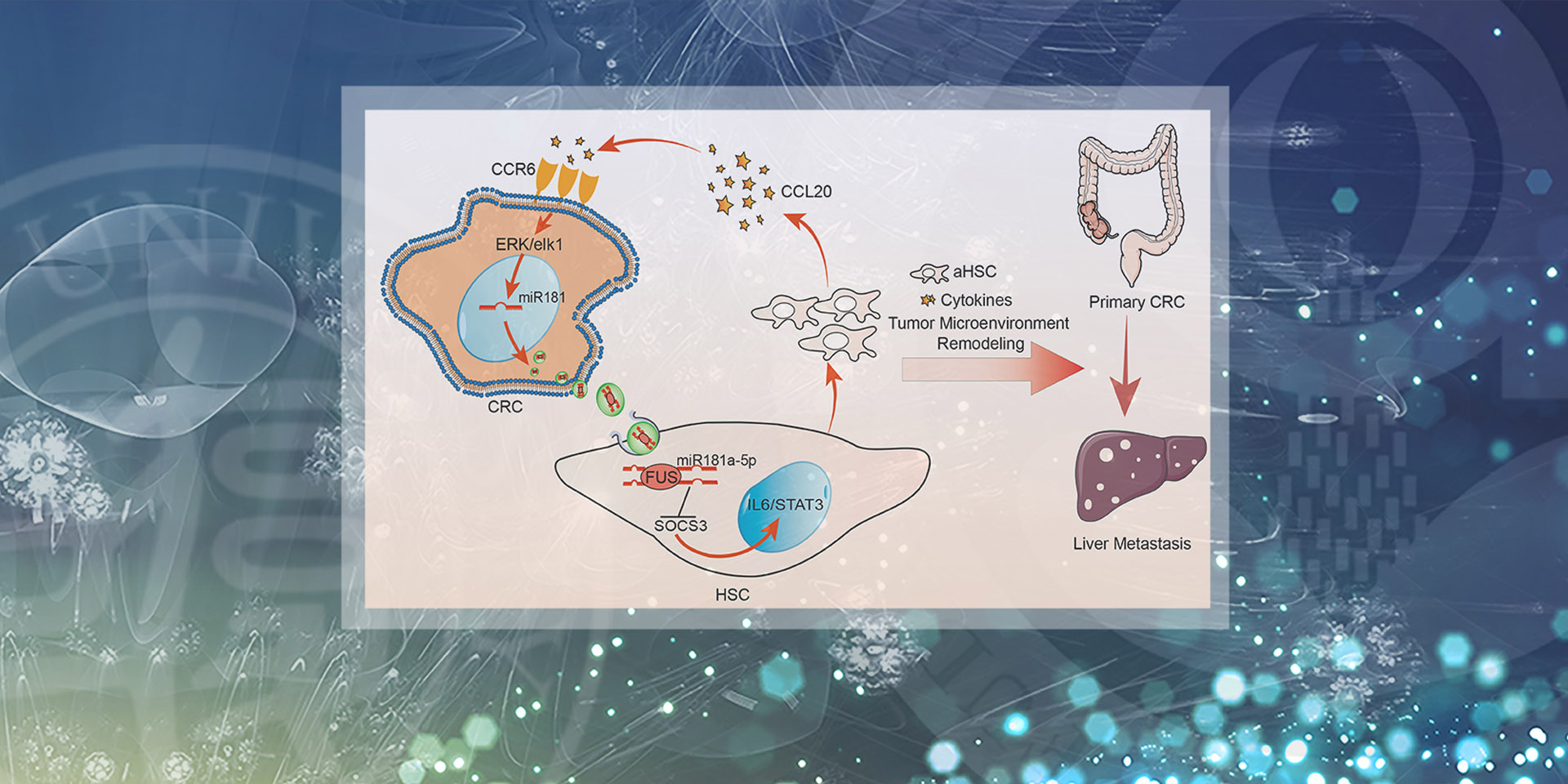
肠癌是如何“跑”到肝脏上的?近日,复旦大学附属肿瘤医院李心翔教授、李大卫教授团队发现了肠癌肝转移的一条潜在“路径”:高度转移性肠癌细胞比低转移潜能的肠癌细胞,能够释放出更多富含小分子核酸miR-181a-5p的细胞外囊泡,进而激活肝脏星状细胞,重塑肝脏中的肿瘤微环境,从而促进肠癌发生肝转移。该研究成果为揭示肠癌肝转移的潜在机制提供了新的见解。国际权威学术期刊《细胞外囊泡杂志》(影响因子25.846分)于日前在线发表了这项研究成果。
“我国居民大肠癌发病人数在国际上位居前列,且死亡率也明显高于西方发达国家,其中一个重要的原因便在于我国多数肠癌患者在发现病情时已经出现了转移,”复旦大学附属肿瘤医院李心翔教授表示,“肝脏是肠癌发生转移的‘头号’目的地。在我国有50%的肠癌患者死亡是由于肝转移导致。发现肠癌肝转移的机制对于临床优化肠癌治疗策略,提升肠癌整体疗效具有重要价值。”
肿瘤细胞与肿瘤微环境之间的相互作用在肠癌肝转移中发挥了重要作用。但是,关于这种相互作用的具体机制目前尚不明晰。
既往研究显示,肝脏星状细胞在肝脏中通常处于“安静”状态,在受到刺激损伤后会被“激活”成为活化型的星状细胞。这种“动若脱兔”的活化型星状细胞在继发性或者原发性肝癌中非常常见;此外,这种细胞还可以通过重塑和沉积细胞外基质影响肠癌细胞的生长和侵袭。而细胞外囊泡是另一种广泛存在于细胞分泌物和各种体液中的囊泡状小体,通常被认为参与到细胞信息传递、肿瘤微环境构成等过程中,且已经证明在几种癌症进展中发挥了重要作用。
李心翔教授、李大卫教授团队基于前期研究推测,肠癌细胞很可能通过衍生的细胞外囊泡调节了活化型的肝脏星状细胞,进而诱导了肠癌肝转移。然而,这一机制假设以及参与该机制的“信使”仍有待进一步确定。
后续研究纳入临床肠癌肝转移患者生物大样本,并通过电子显微镜评估样本中提取的细胞外囊泡形态与数量,并进一步分析这些物质在肠癌肝转移中的机制。
结果显示,来自高转移性肠癌细胞的细胞外囊泡在肠癌肝转移过程中激活了肝脏星状细胞;其中富含小分子核酸miR-181a-5p的细胞外囊泡可作为肠癌肝转移机制中的“信使”,激活肝脏星状细胞从而导致细胞微环境的重塑。此外,活化的肝脏星状细胞调控肠癌细胞中小分子核酸miR-181a-5p 的表达,在肠癌细胞和肝脏星状细胞之间形成正反馈回路,最终导致了肠癌肝转移。
“该结果揭示了肠癌肝转移的潜在机制,为相关研究的深入开展提供了新的方向,”李心翔教授说,“同时在该项研究中,我们还证实肠癌细胞衍生的细胞外囊泡小分子核酸miR-181a-5p在肠癌肝转移中发挥了关键作用,有望成为肠癌肝转移的新型生物标志物。”
据了解,作为具有广泛影响力的大肠癌诊治中心,2021年肿瘤医院大肠癌手术总量超过4000例,大肠癌患者术后1年、3年、5年总体生存率分别为95.25%、82.76%、73.87%。I期、II期、III期和IV期住院手术患者5年生存率分别为91.92%、87.15%、70.49%和27.70%,达到国际先进水平。
此外,在医院大肠癌多学科综合诊治平台上各科专家的共同协作下,肠癌肝转移患者如果肿块体积适中且肝脏外无其他转移灶,也有可能获得手术根治的机会。肿瘤医院数据显示,肠癌肝转移经过肝切除的患者5年生存率提高至33.87%。对于无法获得手术机会的肠癌肝转移患者,通过多学科团队综合诊治团队制定的个性化方案,亦可以获得长期生存。